310. Серые кардиналы: бактерии, генная инженерия и CRISPR Павел Калиниченко
 Источник: https://zen.yandex.ru/media/id/5f6736a0ca481a67f0bd9448/vnimanie-produkty-s-gmo-5f74db47cdcd4964277e3107Можно очень долго описывать взаимоотношения людей с природой и, в частности, «приручение» диких растений для служения роду человеческому, а потом перейти к научному описанию этого процесса, именуемого селекцией. Но я хочу начать с цитирования одного из величайших умов отечественной и мировой селекции/генетики Николая Ивановича Вавилова: «Селекция как наука оформилась лишь в последние десятилетия. В прошлом она была больше искусством, чем наукой. Навыки, знания и конкретный опыт, нередко засекреченный, были достоянием отдельных хозяйств, переходя от поколения к поколению. Только гению Дарвина удалось обобщить весь этот огромный и разрозненный опыт прошлого, выдвинув идею естественного и искусственного отбора как основного фактора эволюции наряду с наследственностью и изменчивостью».
Источник: https://zen.yandex.ru/media/id/5f6736a0ca481a67f0bd9448/vnimanie-produkty-s-gmo-5f74db47cdcd4964277e3107Можно очень долго описывать взаимоотношения людей с природой и, в частности, «приручение» диких растений для служения роду человеческому, а потом перейти к научному описанию этого процесса, именуемого селекцией. Но я хочу начать с цитирования одного из величайших умов отечественной и мировой селекции/генетики Николая Ивановича Вавилова: «Селекция как наука оформилась лишь в последние десятилетия. В прошлом она была больше искусством, чем наукой. Навыки, знания и конкретный опыт, нередко засекреченный, были достоянием отдельных хозяйств, переходя от поколения к поколению. Только гению Дарвина удалось обобщить весь этот огромный и разрозненный опыт прошлого, выдвинув идею естественного и искусственного отбора как основного фактора эволюции наряду с наследственностью и изменчивостью».
Что такое селекция и какие методы до сих пор применяются
Селекция растений нужна для выявления образцов с наилучшими признаками по устойчивости своего вида к тем или иным болезням, вредителям, к неблагоприятным погодным условиям, а также образцов, которые дают больше урожая лучшего качества. Общая идея простая и конкретизированная, а вот методы, к которым прибегают ученые в достижении данных целей, с каждым разом становятся все сложнее, но интереснее.
Ключевые методы селекции растений:
- массовый отбор,
- индивидуальный отбор,
- инбридинг,
- полиплоидия,
- гибридизация внутривидовая и отдалённая,
- искусственный мутагенез.
А теперь рассмотрим каждый способ отдельно. Где-то буду краток, а о некоторых, наиболее распространенных и интересных – расскажу подробнее.
Массовый отбор.
Здесь буду краток. Это самый первый вид селекции. Он стартовал с переходом человека к оседлому образу жизни. Основной принцип: бери растения, которые нравятся по любому внешнему признаку (фенотипу), например, по размеру листа, плода, семени, высоте растения, его ветвистости и т.д., и высаживай их отдельно. С пониманием физиологии и генетики растений добавилось несколько правил к данной методике, касающихся, в частности, самоопыляемых и перекрестно опыляемых растений.
Индивидуальный отбор.
Это следующая ступень развития селекции, на которой мы перестаем опираться только на фенотипические признаки растений, и включаем ещё отбор по генотипу. Однако такой метод требует значительно больше усилий. Дело в том, что каждое растение отбирается отдельно, и его потомство выращивается также отдельно. Метод хорошо подходит для растений самоопылителей, к которым относятся такие культуры, как горох, пшеница, ячмень, фасоль и др. На растениях с перекрестным опылением, когда они переопыляются между собой, и возникает расщепление признаков, необходимо вводить непрерывный многократный отбор (и не одного растения, а всей семьи, то есть потомства одного растения).
Инбридинг (инцухт-гетерозисные скрещивания)
Это близкородственное скрещивание, но в случае с растениями имеет место быть самоопыление перекрестноопыляемых растений. Методика всё ещё относится к первоначальному принципу селекции, а именно к отбору. В этом случае, как и в последующих, создание образцов будет происходить в принудительном порядке, искусственно увеличивая разнообразие форм. Близкородственное скрещивание применяется для перевода большинства генов сорта в гомозиготное состояние и, как следствие, закрепляет новые хозяйственно полезные и ценные признаки у потомства.
Гибридизация внутривидовая и отдалённая
Просто гибридизация — это процесс получения гибрида (от лат. hibrida, hybrida — помесь). Очевидность предыдущего предложения и некоторых последующих зашкаливает, но тут ничего не поделать. Начнем и практически сразу закончим с понятием “внутривидовой гибридизации”. Здесь все так же очевидно, как и в начале раздела. Скрещивание происходит между растениями одного вида, разновидности, линий или сорта. С помощью этого вида селекции создано большинство современных сортов сельскохозяйственных культур. А вот отдалённая гибридизация – это более сложный и трудозатратный процесс. Одна из основных сложностей при получении отдаленных гибридов – несовместимость половых клеток, да-да, у растений тоже присутствуют половые клетки, а также стерильность гибридов первого поколения и последующих. Преодолеть эту проблему в ряде случаев позволяет полиплоидия или беккросс. Всё-таки придётся углубиться и пояснить ещё пару понятий. Беккросс или возвратное сращивание – это когда потомство от двух видов скрещивают с одной или обеими родительскими формами или аналогичной по генотипу, здесь вроде всё просто. Полиплоидия – кратное увеличение числа хромосом, например, х2, х4 и так далее. Один из самых распространенных методов получения полиплоидов – это обработка зародышей, проростков колхицином (алкалоид растительного происхождения).
Искусственный мутагенез
В широком смысле мутации в селекции растений делятся на два типа: естественные и искусственные. Естественный мутагенез происходит без участия человека, под воздействием на организм естественных факторов окружающей среды, например, ультрафиолета, радиации и др. В отличии от естественного хода эволюции, при котором закрепляются только полезные свойства, при мутации происходят изменения, которые могут никак не влиять на выживаемость вида. При искусственном мутагенезе происходит, в принципе, то же самое, что и при естественном, только под строгим наблюдением людей в белых халатах! А ещё добавится работенка по проверке полученных мутантов и отбору наилучших.
 Источник: https://www.serietotaal.nl/nieuws/18954/disney-komt-met-een-nieuwe-x-men-serieТеперь немного раскроем тему искусственного мутагенеза. Сначала поговорим о том, что вызовет мутацию и поделим мутагенез на три основные категории:
Источник: https://www.serietotaal.nl/nieuws/18954/disney-komt-met-een-nieuwe-x-men-serieТеперь немного раскроем тему искусственного мутагенеза. Сначала поговорим о том, что вызовет мутацию и поделим мутагенез на три основные категории:
- физический (радиационный),
- химический,
- биологический.
Радиационный мутагенез происходит под воздействием ионизирующего излучения: коротковолнового, ультрафиолетового (УФ), рентгеновских лучей, гамма-лучей, тепловых и быстрых нейтронов и СВЧ-излучения. Далее всё как в лучших новостных блоках… свободные радикалы… бла-бла-бла… на клеточном уровне… «все плохо, а особенно 5G!!!».
Теперь кратко о химических мутагенах. Тут пропустим подробности воздействия на клетки. Просто запомните, к таким мутагенам относятся альдегиды, нитриты, гидроксиламин, азотистые соединения, алкилирующие соединения (этиленимин, нитрозоэтилмочевина, этилметансульфонат и др.). Эти химические вещества вступают в реакцию с нуклеиновыми основаниями (это то, что в ДНК, и нарушают принцип комплементарности, известный всем из школьного курса биологии).
Биологические мутации, как говорится, на злобу дня. Данный вид мутаций может происходить под воздействием вирусов, чистых ДНК, антивирусных вакцин. Механизм действия биологических факторов не вполне ясен. Они вызывают нарушение процесса рекомбинации. Но! Все испытания проводятся на отдельных клетках, одноклеточных организмах, растениях, простейших формах. Для влияния на большой и сложный организм, вроде человека, где и без этого в отдельных клетках периодически происходят мутации, этого недостаточно.
CRISPR
19 ноября 2018 года накануне второго Международного саммита по редактированию генома человека в университете Гонконга Хэ Цзянькуй объявил о проекте по созданию первых в мире людей с искусственно измененными генами – двух девочек-близнецов Лулу и Нана (настоящие имена неизвестны). После этого события во всем мире начали бурно обсуждать CRISPR-технологию.
Спойлер – в разделе речь пойдет о бактериях и о том, почему именно им мы обязаны существованию генной инженерии.
 Источник: https://www.dekhnews.com/wp-content/uploads/2018/11/bebe-china-1-e1543354681173.jpgДавайте вспомним про дезоксирибонуклеиновую кислоту (ДНК), так как в дальнейших разделах речь пойдет как раз о работе с этой структурой. Молекула ДНК состоит из двух связанных цепочек, где вторая выступает в качестве резервной копии и хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов.
Источник: https://www.dekhnews.com/wp-content/uploads/2018/11/bebe-china-1-e1543354681173.jpgДавайте вспомним про дезоксирибонуклеиновую кислоту (ДНК), так как в дальнейших разделах речь пойдет как раз о работе с этой структурой. Молекула ДНК состоит из двух связанных цепочек, где вторая выступает в качестве резервной копии и хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов.
В молекуле нуклеотида в каждой из цепочек присутствует азотистое основание, которым он соединяется с основанием нуклеотида на противоположной цепочке, тем самым образовывая структуру двойной спирали молекулы ДНК.
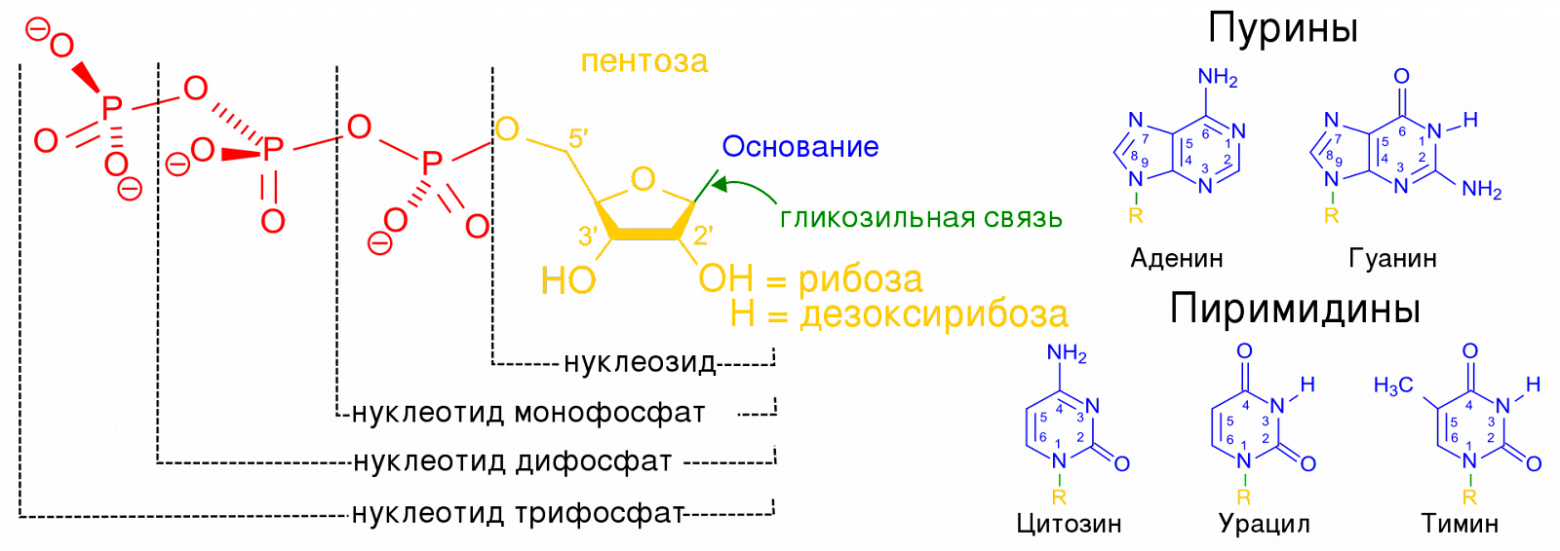 Строение нуклеотидов. Источник: https://upload.wikimedia.org/wikipedia/commons/thumb/6/61/Nucleotides.RU.1.svg/1920px-Nucleotides.RU.1.svg.png
Строение нуклеотидов. Источник: https://upload.wikimedia.org/wikipedia/commons/thumb/6/61/Nucleotides.RU.1.svg/1920px-Nucleotides.RU.1.svg.png 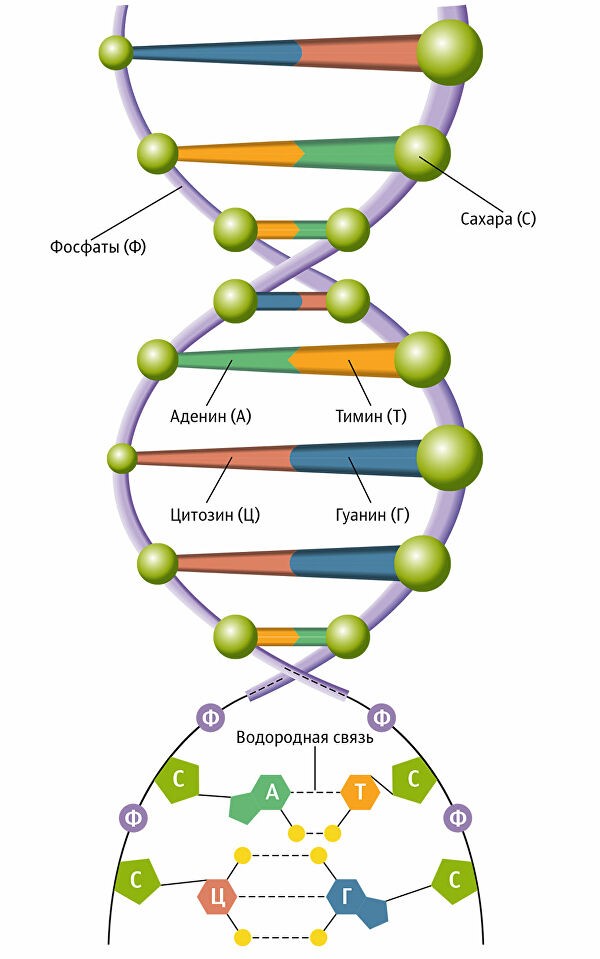 Схема ДНК. Источник: https://ria.ru/20180425/1519327329.html#pv=g%3D1519327329%2Fp%3D1519292712К азотистым основаниям относят хорошо всем известные по курсу школьной биологии аденин, гуанин, цитозин, тимин. Есть еще урацил, который входит в состав рибонуклеиновой кислоты (РНК). Азотистые основания соединяются друг с другом согласно принципу комплементарности, когда одно основание соединяется с определенным другим. На основе данного принципа аденин соединяется с тимином, гуанин – с цитозином.
Схема ДНК. Источник: https://ria.ru/20180425/1519327329.html#pv=g%3D1519327329%2Fp%3D1519292712К азотистым основаниям относят хорошо всем известные по курсу школьной биологии аденин, гуанин, цитозин, тимин. Есть еще урацил, который входит в состав рибонуклеиновой кислоты (РНК). Азотистые основания соединяются друг с другом согласно принципу комплементарности, когда одно основание соединяется с определенным другим. На основе данного принципа аденин соединяется с тимином, гуанин – с цитозином.
В структуре ДНК зашифрованы данные о том, какие белки надо строить в нашем организме. На основе тех белков, которые в нас есть, строится наш организм, зависит то, как мы выглядим и устроены. С ДНК снимается временная копия в виде молекулы РНК, которая имеет схожее, но уже одноцепочечное строение, с которого считывается последовательность нуклеотидов и строится необходимый белок. Алгоритм, по которому последовательность нуклеотидов в ДНК переводится в белковую последовательность аминокислот, называется “генетический код”.
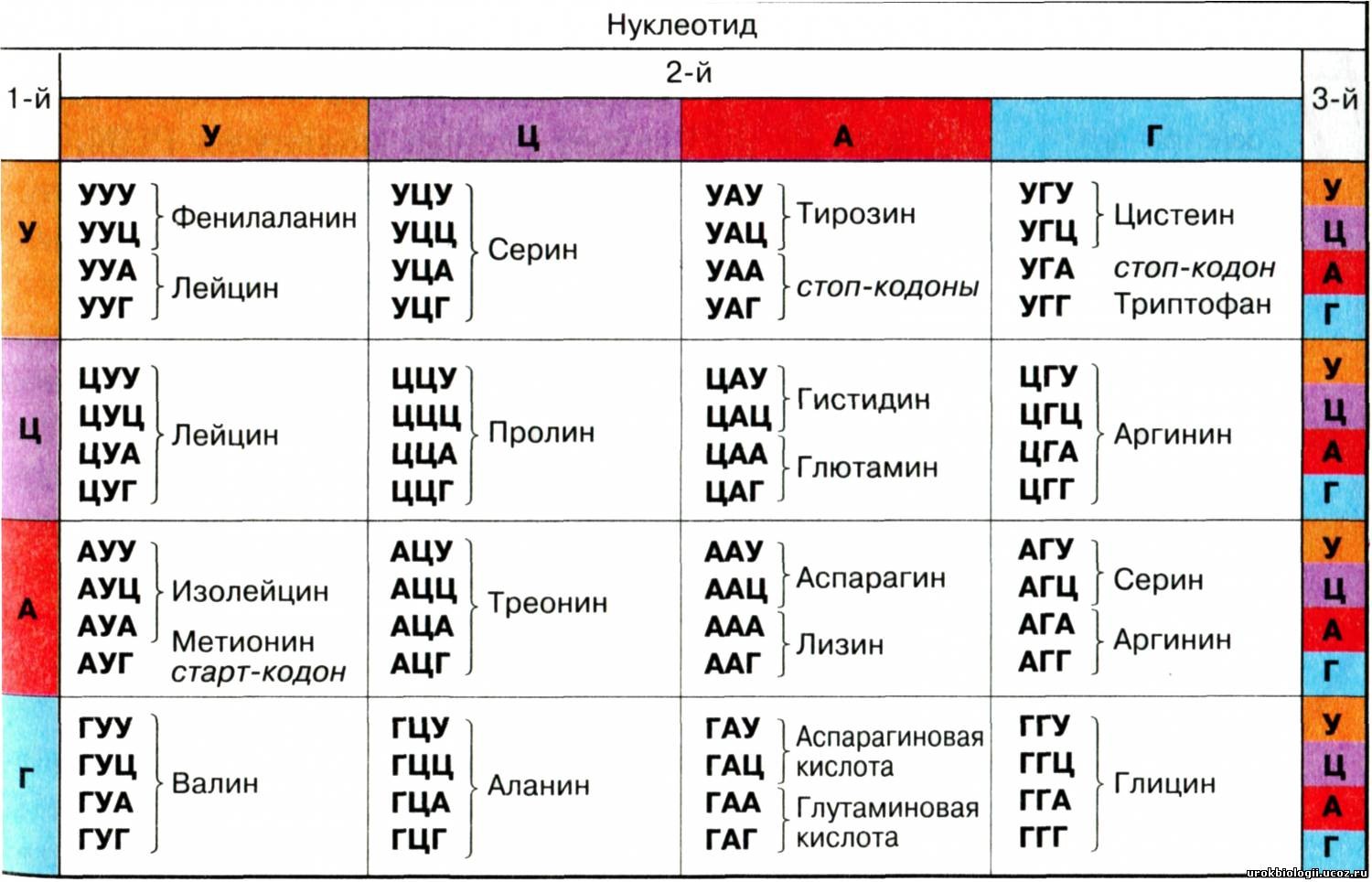 Таблица генетического кода и части белков, которые он кодирует. Источник: https://stepik.org/lesson/199638/step/1Соответственно, если мы внесем изменение в какой-нибудь значимый участок ДНК, то это повлияет на то, какой белок у нас будет формироваться, а значит, это повлияет на то, каким будет организм.
Таблица генетического кода и части белков, которые он кодирует. Источник: https://stepik.org/lesson/199638/step/1Соответственно, если мы внесем изменение в какой-нибудь значимый участок ДНК, то это повлияет на то, какой белок у нас будет формироваться, а значит, это повлияет на то, каким будет организм.
Теперь немного о бактериях и о том, почему именно им мы обязаны существованию генной инженерии. Бактерии, как и люди, подвержены вирусам. Такие вирусы называются «бактериофаги» или просто «фаги». У бактерий и фагов существует множество способов противостояния друг другу. Бактериофаги как и вирусы человека помещают в бактерию свою ДНК и благодаря ресурсам клетки клонируют себя. Для клетки последствия этого не самые лучшие: она лопается и умирает. Защита бактерий очень схожа с защитой человека от вирусов и тех же бактерий – это иммунитет.
Иммунитет можно поделить на два типа: адаптивный и врожденный. С адаптивным иммунитетом многие из нас знакомы по вирусу гриппа. Когда человек заболевает новым штаммом гриппа, организму необходимо некоторое время для выработки иммунитета, а после этого данный штамм становится нам не страшен. С врожденным иммунитетом немного проще, если он у вас хорошо действует, вы не узнаете, против чего он работает.
У бактерий система защиты очень похожа на нашу. Аналогом нашего врождённого иммунитета можно назвать систему рестрикции-модификации. При попадании чужеродной ДНК в бактерию специальные белки рестриктазы нарежут чужеродную ДНК на мелкие кусочки. Для того, чтобы рестриктаза могла отличить чужеродную ДНК от ДНК собственной бактерии, на последней бактерия вносит небольшие изменения, по которым белки рестрикции ее идентифицируют.
Рестриктазы долгое время являлись основным инструментом генной инженерии, так как они могут разрезать ДНК, и впоследствии в разрез можно запихнуть собственный кусок ДНК и собрать новую конструкцию. Интересное замечание: чтобы разрезать ДНК, используется часть, заимствованная у бактерии, а чтобы склеить – используется фермент, позаимствованный у фага. Далее такие новые конструкции мы можем поместить в растения или животных и получить их ГМО-версии.
Рестриктазы получают отдельно из различных бактерий, так как они очень специфичны к определенному участку ДНК. Рестриктазы производят на коммерческой основе, есть каталог, по которому их можно подобрать и заказать.
 Некоторые рестриктазы класса II Источник: https://chem21.info/page/016007123247242147072219076049218031069152046236/Все ГМО, в том числе растения и светящиеся животные, не обходятся без использования рестриктаз. Аналогом нашего адаптивного иммунитета является CRISPR – Clustered Regularly Interspaced Short Palindromic Repeat.
Некоторые рестриктазы класса II Источник: https://chem21.info/page/016007123247242147072219076049218031069152046236/Все ГМО, в том числе растения и светящиеся животные, не обходятся без использования рестриктаз. Аналогом нашего адаптивного иммунитета является CRISPR – Clustered Regularly Interspaced Short Palindromic Repeat.
CRISPR-технология была открыта совсем недавно. Стало неожиданным, что у бактерий есть аналог адаптивного иммунитета. В этом случае при попадании чужеродной ДНК в клетку бактерии, она также нарезается на кусочки. Только эти кусочки не выкидываются, а встраиваются в собственную ДНК бактерии. Вставляются не в любой участок, а в специализированный, который называется CRISPR-кассета.
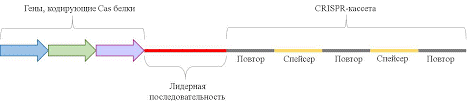 CRISPR-кассета. Источник: https://dspace.spbu.ru/bitstream/11701/26018/1/Issledovanie_CasX_nukleazy_iz_Deltaproteobacteria.pdfСпейсеры – это и есть кусочки фагов, разделенные повторяющейся последовательностью и упакованные таким образом в ДНК бактерий. Рядом с CRISPR-кассетой есть гены Cas-белков, которые аналогичны рестриктазе. После того, как кусочки чужеродной ДНК сохранились в CRISPR-кассеты, собираются Cas-белки по генам и из crispr-кассеты в них добавляется РНК, который соответствует одному кусочку фага. Этот комплекс уже готов работать. При повторном попадании фаговой ДНК в бактерию данный комплекс садится на нее и начинает передвигаться, пока не найдет совпадения по принципу комплементарности с имеющимся у него РНК, а после этого режет фаговый ДНК для его уничтожения.
CRISPR-кассета. Источник: https://dspace.spbu.ru/bitstream/11701/26018/1/Issledovanie_CasX_nukleazy_iz_Deltaproteobacteria.pdfСпейсеры – это и есть кусочки фагов, разделенные повторяющейся последовательностью и упакованные таким образом в ДНК бактерий. Рядом с CRISPR-кассетой есть гены Cas-белков, которые аналогичны рестриктазе. После того, как кусочки чужеродной ДНК сохранились в CRISPR-кассеты, собираются Cas-белки по генам и из crispr-кассеты в них добавляется РНК, который соответствует одному кусочку фага. Этот комплекс уже готов работать. При повторном попадании фаговой ДНК в бактерию данный комплекс садится на нее и начинает передвигаться, пока не найдет совпадения по принципу комплементарности с имеющимся у него РНК, а после этого режет фаговый ДНК для его уничтожения.
Теперь немного об истории этого открытия. В 1987 году была выпущена статья, которая никак не относилась к изучению иммунитета бактерий. В статье описывалось изучение какого-то гена кишечной палочки. В ее конце авторы указали, что они обнаружили рядом с их изучаемым геном интересную последовательность в виде разных последовательностей, разделенных одинаковыми повторами. На тот момент объяснений данному участку ДНК и за что он отвечает, дано не было. Этот участок получил название только в 2002 году – Clustered Regularly Interspaced Short Palindromic Repeat (CRISPR).
Понимание, для чего это нужно, появилось примерно в 2007 году с бактериями для получения молочных продуктов, в том числе и сыра. Бактерии стали сильно поражаться вирусом, и часть из них погибала, от чего возникали большие сложности на производстве сыра. Началось изучение вопроса, что мешает части бактерий жить и не умирать. Когда стали сравнивать бактерии, которые умирали, с теми, которые не поражались, то заметили разницу как раз в CRISPR-кассете. У тех бактерий, которые не поражались вирусом в CRISPR-кассете, было ровно на один повтор больше. Самое удивительное, что этот повтор был похож на последовательность ДНК фагов, которыми они болели в этот момент. Всё встало на свои места, и ученые быстро разобрались, как это работает. В 2013 году уже появились первые научные работы о том, как это можно применить.
В чем особенность применения Cas-белков от рестриктазы? Использование таких структур на основе Cas-белков позволяет нам разрезать ДНК в произвольном месте. Для этого мы в Cas-белок помещаем вместо РНК фага собранную нами РНК, тем самым направляя белок на нужный участок ДНК, и делаем двуцепочечный разрыв. Для клетки такой разрыв очень неправильный, и она пытается это решить разными способами, из которых нам интересны два.
Первый способ – очень быстро кое-как их соединить. При таком варианте получается очень быстро, но неточно, и в процессе такого ремонта на стыке может как потеряться какой-нибудь участок, так и образоваться новый. При втором варианте разрыва нам необходим какой-нибудь образец новой последовательности аминокислот, по которому ДНК может быть восстановит свой поврежденный участок. Образец может быть не идентичен исходному, и в нем могут быть изменения, которые перенесутся в исходную ДНК. Первый способ называется «негомологичное соединение концов», а второй – «гомологичная рекомбинация».
Подведем промежуточный итог. Для того, чтобы сделать разрез, нам понадобится Cas-белок, РНК, которую мы можем синтезировать сами, и опционально образец ДНК.
Не все так гладко, как кажется на первый взгляд. При использовании данной технологии существуют некоторые сложности. Первой сложностью можно назвать off-target-эффект. ДНК молекулы очень длинные, с большим количеством последовательностей, поэтому на ней могут находиться участки не точно, но похожие на тот, на который мы нацелились. В этом случае Cas-структура разрежет в нескольких местах, а этого нам не надо. Ко второй проблеме можно отнести соотношение двух ранее упомянутых путей восстановления разрезанной ДНК. Подставляя образец ДНК, нет гарантии (точнее она очень мала), что процесс восстановления пойдет по нему, а не кое-как.
Есть интересное решение этих проблем, которое может в той или иной степени помочь. В системе Cas-белка ломается часть, которая разрезает одну из цепей ДНК (для уточнения: в данной системе есть две структуры для разреза, и каждая для своей нити ДНК). Далее берутся две такие системы и сажаются на ДНК. При этом нам надо подобрать направляющие РНК так, чтобы системы сели рядом друг с другом, и получится, что они сделают два одноцепочечных разрыва рядом друг с другом. Такие модифицированные Cas-системы называются “никаза”. При этом разрезе клетка сильно не паникует, и вероятность сделать гомологичную рекомбинацию становится выше. Также уменьшается вероятность, что две системы найдут схожие участки рядом, тем самым практически исключается off-target-эффект.
Генетически модифицированные эмбрионы
В 2017 году проводились испытания на клетках человека, но в этом испытании дальше эмбрионов не заходили. На стадии зиготы провели генное редактирование с применением ДНК-образца и получили на выходе разный набор эмбрионов, в части которых изменений не было, часть представляла собой набор из клеток, где прошли изменения в разной степени, а часть была полностью нормально отредактирована. Данная технология, при которой из человека берутся клетки, редактируются и помещаются обратно, может применятся в медицине при лечении генетических заболеваний. Клинические испытания в данном направлении проводятся с 2018 года.
К чему могут привести внесение таких мутаций в ДНК
Мутации в живых организмах – это естественный процесс, при котором случаются также полезные мутации, например, благодаря им люди смогли усваивать лактозу. Примерно 40 мутаций получает каждое последующее поколений от предыдущего, при этом данный процесс нами не контролируется, а при геномном редактировании мы точно знаем, что и где мы заменяем и стараемся сделать что-то полезное.
Вернемся к Хэ Цзянькую и тому, что он сделал. Ученый взял женские и мужские половые клетки у пар, провел с ними экстракорпоральное оплодотворение (ЭКО), а впоследствии отредактировал ген CCR5 в эмбрионах с помощью CRISPR. Данный ген кодирует белок, при помощи которого ВИЧ проникает в наши клетки. Хэ Цзянькуй пытался провести мутацию CCR5-∆32, которая уже присутствует у некоторой части населения нашей планеты и благодаря которой эти люди невосприимчивы к ВИЧ. Также интересно, что отключение гена CCR5 имеет положительный побочный эффект на развитие мозга: улучшается память, повышается способность мозга восстанавливаться после инсульта, а также, возможно, есть связь с более высокой успеваемостью в школе и умственными способностями.
Более подробно про технологию CRISPR можно узнать по ссылке.
В заключении хотелось бы добавить, что всему свое время и прогресс необходим. Классическая селекция применялась, когда необходимо было накормить меньшее количество людей. Со временем население планеты начало увеличиваться в нелинейной прогрессии, появилась необходимость в более короткие сроки получать сорта культурных растений с повышенной урожайностью. Шло время, началась борьба за то, чтобы все посаженные растения сохранились и дали урожай. Для достижения таких результатов, помимо использования различных средств защиты растений, необходимо было начинать более сложные процессы селекции в виде отдаленной гибридизации и мутагенеза, чтобы выводить сорта, устойчивые к заболеваниям и вредителям. Новые технологии, появившиеся с генной инженерией, помогают нам проводить те же самые процессы, как в природе и классической селекции, только с большей точностью и скоростью.
